🄲🄷🄴🄼🄸🄲🄸 🧪
Канал для тех,кто по-настоящему хотят стать успешными, развитыми и оставить своё яркое ФИО в истории человечества🌍
Публикации и посты для школьников, абитуриентов, студентов и учителей 💯
За Рекламой: @KholikovJamshid
Прейскурант: @pricelist_chemici Related channels | Similar channels
7 239
subscribers
Popular in the channel
Post #14755:
💚Специально для тех кто хотят порадовать родителей своим грантом😍 - мы открываем «Chemici Mega Pl...
💜счастье это - получить А+ сертификат
🍰Отзывы с занятий в закрытых группах : Мы открыли проект Chemici Mega Plus , и разделили гр...
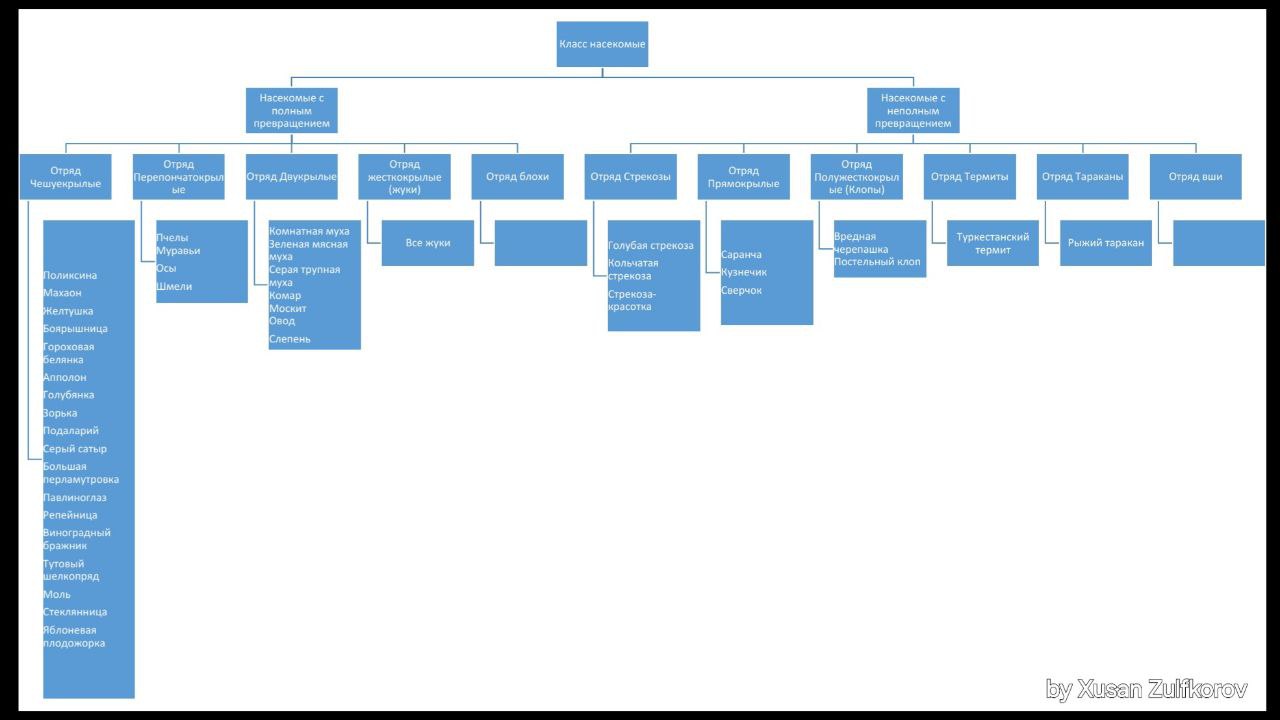
Классификация по насекомым✌️🐝🪰🐜🐞🪲🪳 Давайте повторим и закрепим ✨ 🄲🄷🄴🄼🄸🄲🄸 🧪




